又一家押注PD-1热门赛道的创新药企开启赴港上市之路。
公开信息显示,创新药企业翰思艾泰生物医药科技(武汉)股份有限公司(简称“翰思艾泰”)的独家保荐人为工银国际,IPO前公司共完成三轮融资,2024年6月的B+轮融资后公司估值约16.15亿元。
在一众赴港上市的企业中,尚未盈利的创新药企并不少见,但随着近两年创新药板块热度退潮,如今医药企业在二级市场的股价和估值都趋于低迷。而翰思艾泰身处同质化创新严重的PD-1赛道,上市后又是否能够受到资本市场“待见”?
3款主要产品均处于临床早期
公开资料显示,翰思艾泰是一家拥有结构生物学、转化医学及临床开发方面自主专业技术的创新生物科技公司,致力于通过发现、研发及商业化用于癌症及自身免疫疾病精准治疗的同类首创及╱或同类最佳产品来探索新一代免疫疗法。
肿瘤免疫疗法是一种前景广阔且不断发展的癌症疗法,能够提供比传统疗法更具靶向性且具有潜在长期益处的治疗选项。不过,目前获批的免疫检查点抑制剂疗法亦存在不少局限性,为此学术界普遍采取或寻找新靶点、或改良目前获批的抑制剂的做法。
智通财经APP了解到,翰思艾泰主要通过改良现有靶点抑制剂的方法来进行创新,使用公司专有的VersatiBody平台(一种抗体工程平台)来创造双功能或多功能分子。
截至2024年11月18日,公司拥有由10款创新药构成的多条在研管线。其中,核心产品HX009有3项适应症正在开展临床试验,部分适应症进入临床Ib/II期,属研发进度最快的一款产品;两款主要产品HX301及HX044也各有一项适应症进入临床试验;7款药物处于临床前阶段,包括同类首创的抗体偶联药物候选药物HX111、利用新型OX40靶点的双特异性抗体HX035及HX038等。

核心产品HX009被称为“超级PD-1”分子,是一款经过特别设计的靶向两个免疫检查点(即PD-1和CD47)的双特异性分子,能够增强PD-1抗体的疗效并解决CD47靶向的安全性问题。
另外两款进度较快的在研产品中,HX301是一种多靶点激酶抑制剂,可以靶向包括CSF1R、ARK5、FLT-3及CDK4/6在内的多个靶点。2024年7月,HX301在中国完成了治疗晚期恶性肿瘤的I期临床试验,于8月获批开展与替莫唑胺联用治疗脑胶质母细胞瘤的临床试验,计划于2024年底前开始联合疗法研究。
“超级CTLA-4分子”HX044则是一款双功能抗CTLA-4抗体/SIRPα融合蛋白,可用于治疗多种晚期实体瘤恶性肿瘤,尤其是治疗包括非小细胞肺癌、黑色素瘤等在内的多种PD-1耐药实体瘤。10月HX044在澳大利亚启动I/IIa期临床研究,11月在国内开展治疗晚期实体瘤恶性肿瘤的IND申请获得国家药监局受理。公开资料显示,HX044为全球唯一一项在临床试验阶段的CTLA-4/SIRPα双特异性抗体/双功能融合蛋白。
深陷亏损亟待上市“补血”
作为一家多款重要产品均处于临床早期的创新药企,翰思艾泰在业绩方面的表现较为薄弱。根据招股书披露,除了此前已转让给乐普生物的HX008外,公司并无产品商业化,也未有任何产品销售收入。

智通财经APP了解到,HX008(普特利单抗注射液)是一款PD-1单抗产品,根据转让协议,翰思艾泰可获得一次性现金付款3.5亿元及每年销售净额4.375%的年度特许权使用费,后者于2022年及2023年度的年费约70万元及440万元。
根据乐普生物的2024半年报,上半年普佑恒(普特利单抗注射液)的销售收入约为9480万元,较2023年同期增长115.4%。以此计算,全年翰思艾泰能从普特利单抗中获得的收入预计将超过800万元,大幅超过去年同期。
2022年、2023年和2024年上半年,公司的研发费用分别为5868.4万元、4666.3万元、4203.4万元,亏损总额分别为2511.7万元、8462.3万元、4313.1万元(单位为人民币,下同)。
截至2024年9月30日,翰思艾泰账上现金及现金等价物,以及原到期日超过三个月的定期存款合计为人民币1.53亿元,堪堪够满足未来一年的研发投入。
PD-1赛道内卷严重,研发进展不确定性仍存
作为翰思艾泰的核心产品,HX009的研发进度无疑备受关注。公开信息显示,HX009目前有3个适应症正在同步开展,包括治疗晚期黑色素瘤的HX009-I-01中国研究(Ib期)、治疗R/R EBV+非霍奇金淋巴瘤的HX009-II-02中国研究(I/II期)和联合治疗胆道癌的2期临床试验(今年9月获批)。
而在海外商业化方面,2023年4月翰思艾泰向美国FDA提交在美国开展HX009 Ib/II期临床研究的IND申请,并于2023年5月取得FDA的《临床试验批准函》。
智通财经APP了解到,此前HX009已在澳洲和中国成功完成两项临床I期实体瘤的单药剂量爬坡试验。I期单药数据显示了良好的安全及耐受性,并且在包括胆道恶性肿瘤的多种适应症上观察到单药的抗肿瘤疗效。
然而,从新药研发流程来看,翰思艾泰的多款主要产品均未完成II期临床试验,表明公司后续能否成药仍存在相当大的不确定性。根据Biomedtracker的一项研究,II期临床是最容易失败的阶段,其成功率仅有28%;在另一项研究中,2007-2023年期间,总计34家中国创新药企业的75个新药研发项目发生临床试验阶段改变,其中II期临床的成功率最低,为17%,远低于I期临床和III期临床。
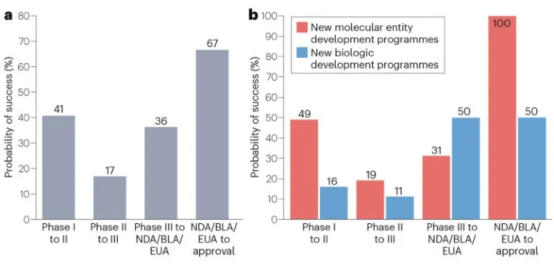
(图:中国创新药在美国临床试验成功情况,a为各临床阶段成功率;b为各阶段按药品类型的成功率)
另一方面,尽管HX009在靶向PD-1/PD-L1及CD47的同类双特异性抗体及双功能融合蛋白产品这一细分领域研发进展领先,但PD-1这一热门抗肿瘤赛道早已成为红海。
智通财经APP了解到,截至目前,国内获批上市PD(L)-1单抗已达到15款之多,获批适应症多则在10种左右。2023年,已有替雷利珠单抗获得欧盟批准,成为首款出海的国产PD-1,特瑞普利单抗则成为首个出海美国市场的国产PD-1。
随着市场同质化产品增多,PD-1赛道的竞争已进入白热化阶段,即便是设计理念更先进的双抗,也有默沙东、BioNTech等多家企业早早入局。根据弗若斯特沙利文数据,除了HX009之外,目前国内还有7款PD-1/CD47及PD-L1/CD47双特异性抗体/双功能融合蛋白管线正在开展研究,全球其他地区另有4款同类产品正在开展研究。
即便翰思艾泰能在PD-1早已卷成红海的市场中分到一杯羹,医保“灵魂砍价”也将成为影响业绩的另一重要因素。今年的医保谈判中,四款国产PD-1抑制剂纳入医保,最高降价幅度达85%。算上慈善赠药,每年治疗费用从11.88万元降至约5万元(医保报销前),医保报销(按照70%的报销比例)后患者实际支付的年治疗费用降至1.5万元左右。此外,全球首款PD-1/CTLA-4双抗卡度尼利单抗也于今年6月降价53.4%。可以预见的是,翰思艾泰的产品在成功上市后,也有很大可能面临大幅降价的问题。
创新药企的市场估值离不开其在研管线的潜在市场前景,在PD-1赛道众多竞争者环伺的当下,主要产品的临床试验均处于早期的翰思艾泰或难获得太多估值溢价。展望未来,临床试验的进展将成为市场投资者的重点关注因素。